-
Zuhause
-
Produkte
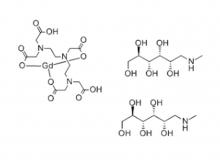
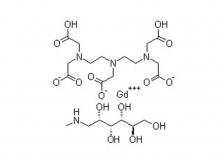
- Gadopentetat Dimeglumine-Injektion/API Gadobutrol-Injektion/API Gadobenat-Dimeglumin-Injektion Eisen-Ammonium-Citrat Brause granulat
- Iohexol-Einspritzung Iopamidol-Injektion Iodixanol-Injektion
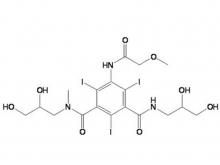
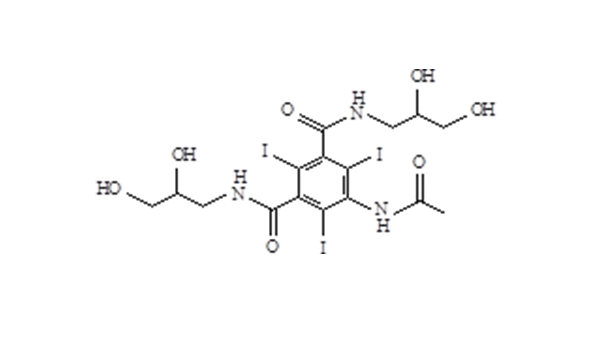
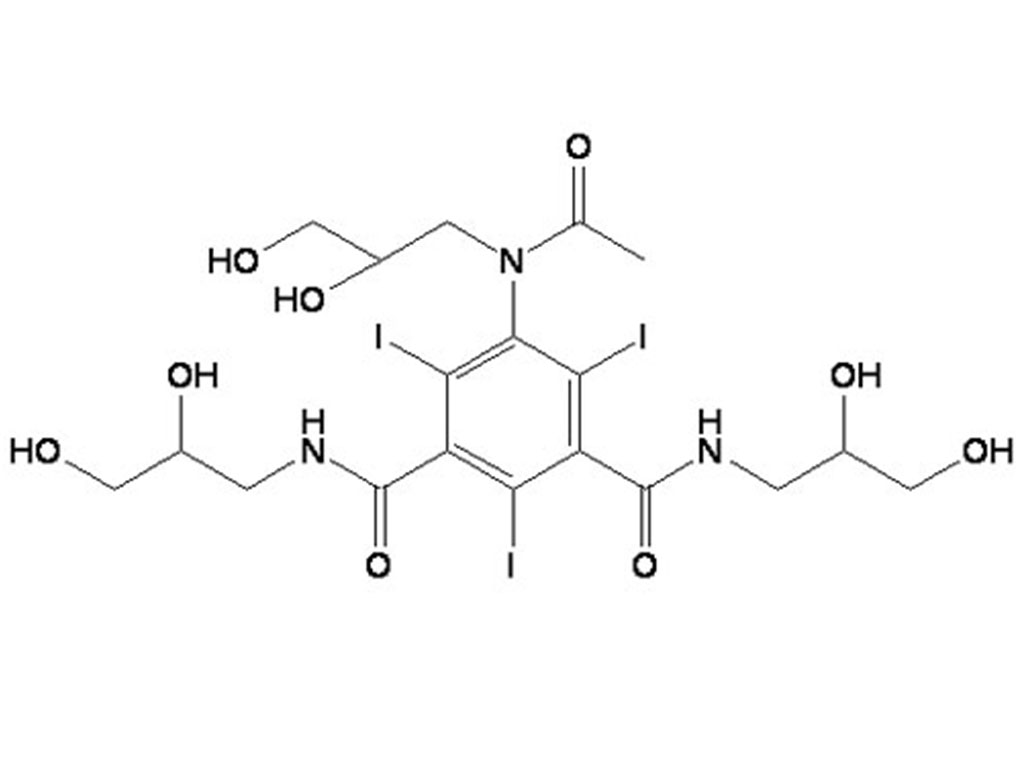
- Iohexol-Zwischen produkt 5-Amino-N,N'-bis(2,3-dihydroxypropyl)-2,4,6-triiodo-1,3-benzenedicarboxamid
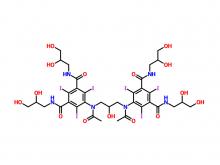
- Iohexol/Isoversol-Zwischen produkt 5-Amino-N, N'-bis(2,3-dihydroxypropyl)-2,4,6-triiodo-1,3-benzenedicarboxamid
- Isoversol-Zwischen produkt (auf Ordnungs basis) N, N'-Bis (2,3-Dihydroxypropyl)-5-(Glycoloyl amino)-2,4,6-triiodoisophthalamid
- Iopamidol Zwischen produkt (auf der Grundlage der Reihenfolge) 5-Amino-2, 4,6-triiodoisophthalsäure
- Iopamidol Zwischen produkt (auf der Grundlage der Reihenfolge) 5-Amino-2, 4,6-triiodisophthaloylsäure di chlorid
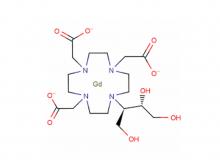
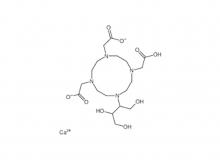
- Diethylen triamin penta essigsäure (DTPA)
-
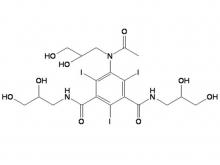
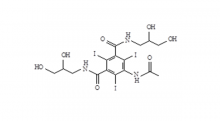 Iohexol-Zwischen produkt 5-Amino-N,N'-bis(2,3-dihydroxypropyl)-2,4,6-triiodo-1,3-benzenedicarboxamid
Iohexol-Zwischen produkt 5-Amino-N,N'-bis(2,3-dihydroxypropyl)-2,4,6-triiodo-1,3-benzenedicarboxamid
-
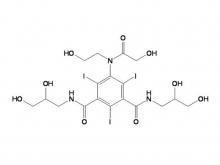
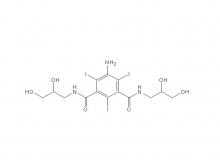 Iohexol/Isoversol-Zwischen produkt 5-Amino-N, N'-bis(2,3-dihydroxypropyl)-2,4,6-triiodo-1,3-benzenedicarboxamid
Iohexol/Isoversol-Zwischen produkt 5-Amino-N, N'-bis(2,3-dihydroxypropyl)-2,4,6-triiodo-1,3-benzenedicarboxamid
-
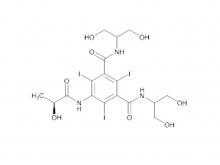
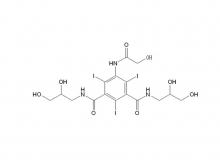 Isoversol-Zwischen produkt (auf Ordnungs basis) N, N'-Bis (2,3-Dihydroxypropyl)-5-(Glycoloyl amino)-2,4,6-triiodoisophthalamid
Isoversol-Zwischen produkt (auf Ordnungs basis) N, N'-Bis (2,3-Dihydroxypropyl)-5-(Glycoloyl amino)-2,4,6-triiodoisophthalamid
-
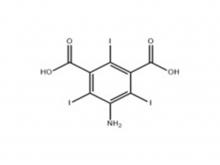 Iopamidol Zwischen produkt (auf der Grundlage der Reihenfolge) 5-Amino-2, 4,6-triiodoisophthalsäure
Iopamidol Zwischen produkt (auf der Grundlage der Reihenfolge) 5-Amino-2, 4,6-triiodoisophthalsäure
-
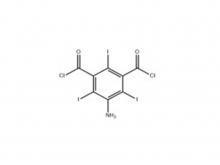 Iopamidol Zwischen produkt (auf der Grundlage der Reihenfolge) 5-Amino-2, 4,6-triiodisophthaloylsäure di chlorid
Iopamidol Zwischen produkt (auf der Grundlage der Reihenfolge) 5-Amino-2, 4,6-triiodisophthaloylsäure di chlorid
-
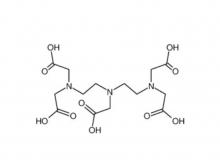 Diethylen triamin penta essigsäure (DTPA)
Diethylen triamin penta essigsäure (DTPA)
- Unternehmen
- Nachrichten
- Kontaktieren Sie uns

 EN
EN
 jp
jp  fr
fr  de
de  es
es  ru
ru  ar
ar 










 Rufen Sie uns an:
Rufen Sie uns an:  Senden Sie uns eine E-Mail:
Senden Sie uns eine E-Mail:  No.3 Shuiyuan West Road, Miyun District, Beijing, China
No.3 Shuiyuan West Road, Miyun District, Beijing, China 